Pozitív biomarkerek hiányában vagy a gyógyszerrezisztencia kialakulása után az immunterápiák, például az immunellenőrző pont inhibitorok, az előrehaladott és áttétes nem-kissejtes tüdőrák (NSCLC) kezelésének szerves részévé váltak.
Ezek az előrelépések ellenére az NSCLC továbbra is a vezető daganatos halálozási ok világszerte. Csak 2017-ben az Egyesült Államokban az NSCLC több rákhoz kapcsolódó halálesetet okozott, mint a prosztatarák, emlőrák, agydaganatok és vastagbélrák együttesen (Siegel et al. 2023). Válaszul a következő generációs terápiák, köztük a bispecifikus antitestek (bsAb-k) megjelenése jelentős reményt nyújt az NSCLC jövőbeni kezelésére.
Ebben a blogban arról beszélünk, hogyan válik egyre népszerűbbé a bsAb-k alkalmazása az NSCLC új kezelési stratégiájaként, és milyen nagy ígéreteket mutatnak a kombinált terápiában a klinikai vizsgálatok során.
Nem-kissejtes tüdőrák – Egy jelentős probléma
Az NSCLC genetikai mutációk következtében alakul ki, amelyek a sejtek háztartási mechanizmusainak szabályozását felborítják, és kontrollálatlan sejtnövekedést eredményeznek. Az epidermális növekedési faktor receptor (EGFR) gén mutációi, amely a sejtosztódást szabályozza, az NSCLC leggyakoribb mutációi közé tartoznak; egy tanulmány szerint Európában az esetek 14%-ában fordulnak elő, különösen az exon 20 régióban (Zhang et al. 2016). Emellett a mesenchymális-epiteliális átmenet (MET) gén mutációi hozzájárulnak a kontrollálatlan sejtnövekedéshez, valamint az EGFR-pozitív betegek esetén az EGFR-gátlókkal szembeni rezisztenciához.
Egyre alaposabb betegségpatogenezis ismeret mellett milyen terápiás lehetőségek állnak rendelkezésre a klinikán?
Az NSCLC szabványos kezelési stratégiáinak kihívásai
A daganatos sejtek műtéti eltávolítása az NSCLC korai stádiumában gyakori kezdeti lépés. Az I. stádiumú NSCLC esetén adjuváns kemoterápia, immunterápia vagy célzott terápia alkalmazható a fennmaradó daganatsejtek ellen, mivel nagyobb a kiújulás kockázata, de ezek nem mellékhatások nélküliek, és nem mindig érik el a kívánt választ. Szükség esetén a műtét után sugárkezelést is alkalmazhatnak. Késői stádiumban a kezelés jelentős szöveteltávolítással járhat, de gyakran alkalmaznak neoadjuváns kemoterápiát immunterápiával és/vagy sugárterápiával kombinálva. Az immunterápiák, például az immunellenőrző pont inhibitorok az elmúlt évtizedben forradalmasították az előrehaladott és áttétes NSCLC kezelését, bizonyos betegek esetén a kemoterápiánál jobb eredményeket mutatva (Desai és Peters 2023). Ennek ellenére az eredmények továbbra is nem optimálisak, sok beteg nem reagál, vagy idővel rezisztenciát fejleszt ki.
Ezért, az immunterápia fejlődése ellenére, továbbra is szükség van új terápiás megközelítésekre az NSCLC kezelésében. A bsAb-k egyre nagyobb teret nyernek, mint a következő generációs daganatellenes bioterápiák, amelyek új képességeket hozhatnak az NSCLC elleni harcban.
Multimodális bispecifikus antitestek tervezése
A bsAb-k iránti klinikai érdeklődés az 1960-as évek óta gyorsan nő, köszönhetően ígéretes terápiás potenciáljuknak és egyedi célzási képességeiknek (Riethmüller 2012). Bár szerkezetileg hasonlóak az egyspecifikus antitestekhez, a bsAb-ket úgy tervezték, hogy két különböző kötőhelyük legyen, amelyek egyszerre képesek két antigént felismerni és kötni (1. ábra, a, b).
A bsAb-k többféle mechanizmuson keresztül működhetnek, beleértve az immunsejtek bevonását, a tumor-asszociált antigének célzását, térbeli gyógyszerelhelyezést vagy immunellenőrző pont blokádot. Bár ezek a megközelítések nagy sikerrel alkalmazhatók hematológiai daganatok kezelésében, a szilárd tumoroknál (amelyek az összes rák mintegy 90%-át teszik ki), például az NSCLC esetén eddig kevésbé voltak hatékonyak (Gu és Zhao 2024). A 14 globálisan engedélyezett bsAb-terápia közül mindössze öt alkalmazható szilárd tumorok ellen, ezért klinikai alkalmazásuk eddig korlátozott volt.
Azonban a legújabb vizsgálatok célja ezen korlátok leküzdése és hatékony bsAb-alapú kezelések fejlesztése szilárd tumorok esetén.
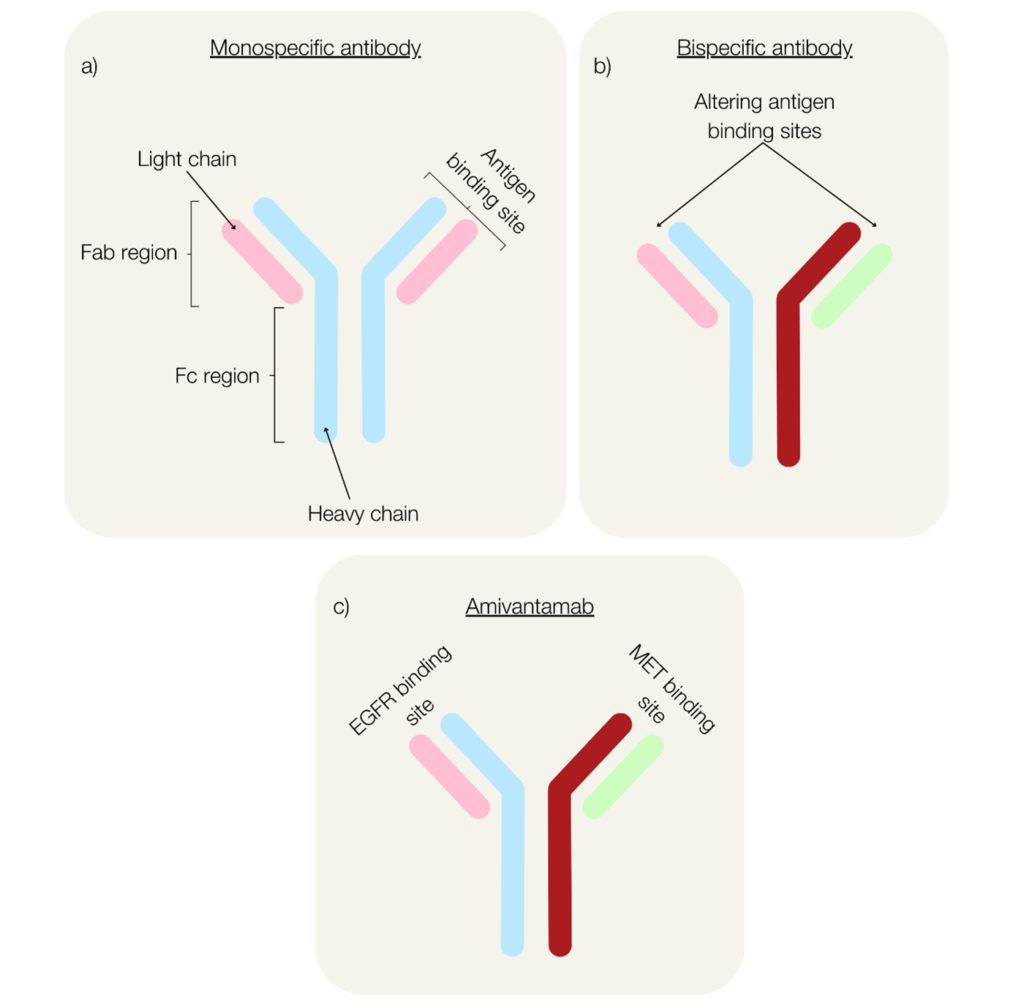 1. ábra. Monospecifikus antitestek (a), bispecifikus antitestek (b) és az NSCLC immunterápia, az amivantamab (c) szerkezete.
1. ábra. Monospecifikus antitestek (a), bispecifikus antitestek (b) és az NSCLC immunterápia, az amivantamab (c) szerkezete.
Amivantamab: Egy potenciális áttörés az NSCLC kezelésében
Az FDA nemrégiben jóváhagyta az amivantamab alkalmazását olyan NSCLC-s betegek esetében, akiknél a betegség platinumalapú kemoterápia után progrediált. A döntés alapját a CHRYSALIS fázis I vizsgálat biztató eredményei képezték (Park et al. 2021). Az amivantamab egy immunrendszert aktiváló bispecifikus antitest, amely az EGFR exon 20 pozitív NSCLC ellen hat úgy, hogy egyszerre célozza meg az EGFR-t és a c-MET-et (1c ábra), ezzel blokkolja a ligandáltali foszforilációt, gátolja a jelpályát, és csökkenti a daganatméretet (Gu és Zhao 2024).
Később az amivantamab hatékonyságát kemoterápiával kombinálva is vizsgálták a PAPILLON klinikai vizsgálatban, ahol a kombinált kezelést a csak kemoterápiát kapó csoporttal hasonlították össze (Zhou 2023). Az elsődleges végpont a progressziómentes túlélés volt, a másodlagos végpontok közé tartoztak a teljes túlélési idő, a válaszreakció időtartama, valamint a tünetmentes progressziómentes túlélés. A vizsgálat szignifikánsan alacsonyabb betegségprogressziót mutatott azoknál a betegeknél, akik amivantamabot kemoterápiával kombinálva kaptak: a progresszió aránya 33% volt a kombinált kezelés esetén, míg a csak kemoterápiás csoportban 69%. Az objektív válaszreakciók aránya 73% volt a kombinációs csoportban, szemben a 47%-kal a kemoterápiás csoportban. A medián progressziómentes túlélés több mint 11 hónap volt a kombinált kezelésnél, szemben a kemoterápia esetén mért 6,7 hónappal. A daganatméret fizikai csökkenése átlagosan 53% volt az amivantamabot is tartalmazó kezelésnél, míg csak kemoterápiánál 34%. A vizsgálat eredményei alapján az FDA jóváhagyta az amivantamab + kemoterápia kombinációs kezelést az NSCLC kezelésére, mivel az jelentősen jobb eredményeket nyújtott, mint a hagyományos terápiák.
Az amivantamab azóta további indikációkra is megkapta az engedélyt: kombinációban kemoterápiával alkalmazható olyan NSCLC-s betegeknél is, akiknél EGFR exon 19 deléció vagy exon 21 L858R mutáció van jelen, és akiknél a betegség EGFR tirozin-kináz inhibitoros kezelés után progrediált – a döntés a MARIPOSA-2 vizsgálat adatai alapján született.
Átalakíthatják-e a bispecifikus antitestek a szilárd tumorok terápiáját?
A jelenlegi kilátások az NSCLC esetében kedvezőtlenek: áttétes NSCLC-nél az 5 éves túlélési arány mindössze 9%. A standard kezelések bár mutatnak némi hatékonyságot, gyakran járnak mellékhatásokkal, nem célzottak, és a progressziómentes túlélés alacsony. Egyes immunterápiák, például az immunellenőrző pont gátlók bizonyos esetekben ígéretes eredményeket hoztak az NSCLC kezelésében, ám sok beteg továbbra sem reagál, vagy kiújul a betegség.
A bispecifikus antitestek – mint például az amivantamab – fejlődése azonban új távlatokat nyit a szilárd tumoros daganatok, köztük az NSCLC kezelése terén. Bár további kutatások szükségesek, a bsAb-k egyre inkább megjelennek a klinikumban mint potenciálisan életmentő, új generációs daganatellenes terápiák.
